一密封体系中发生下列反应:N2 +3H2 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图: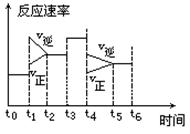
回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?
、 、
(3)下列各时间段时,氨的百分含量最高的是______.
| A.t0~t1 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
相关知识点
一密封体系中发生下列反应:N2 +3H2 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:
回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?
、 、
(3)下列各时间段时,氨的百分含量最高的是______.
| A.t0~t1 | B.t2~t3 | C.t3~t4 | D.t5~t6 |