(12分)根据已学知识,回答下列问题:
(1)具有(n-1)d10n s2电子构型的元素位于周期表中区和族。
(2)写出3P轨道上有2个未成对电子的元素名称:。
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式 。
(4)键能是指气态基态原子形成1 mol化学键释放的最低能量。某些化学键的键能如下表
格所示(单位:kJ·mol-1):
| 键 |
H—H |
N N N |
O=O |
F—F |
H—Cl |
| 键能 |
436 |
946 |
498 |
157 |
431 |
| 键 |
N—N |
P—P |
P—O |
Cl—Cl |
Br—Br |
| 键能 |
193 |
198 |
360 |
242.7 |
193 |
①由表中所列化学键形成的单质分子中,最不稳定的是。
②通过表中键能数据,计算说明N2分子中的键比键稳定(填“ ”或“
”或“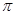 ”)。
”)。
③化学反应的实质是旧化学键断裂和新化学键形成的过程。现有化学反应方程式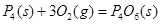 ,通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为kJ。
,通过计算可以确定,1molP4(s)参加该反应, (填“吸收”或“放出”)的热量为kJ。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号