(11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2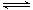 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)
(11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2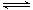 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)