(7分)(1)实验测得:在室温下1L水中只有10-7mol的水电离,列式计算水的电离平衡常数KH2O;
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示,则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由 。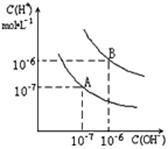
(7分)(1)实验测得:在室温下1L水中只有10-7mol的水电离,列式计算水的电离平衡常数KH2O;
(2)已知水在25℃和100℃时,其电离平衡曲线如图所示,则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由 。