(普通班做)
下图中的实验装置可以用于实验室制取乙炔。请填空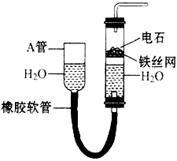
(1)图中,A管的作用是____________。制取乙炔的化学反应方程式为____________。
(2)乙炔通入酸性KMnO4溶液中,发生____________反应,可以观察到____________现象。
(3)乙炔燃烧的化学方程式为________________________,点燃乙炔前应该先________________________。
(普通班做)
下图中的实验装置可以用于实验室制取乙炔。请填空
(1)图中,A管的作用是____________。制取乙炔的化学反应方程式为____________。
(2)乙炔通入酸性KMnO4溶液中,发生____________反应,可以观察到____________现象。
(3)乙炔燃烧的化学方程式为________________________,点燃乙炔前应该先________________________。