(14分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。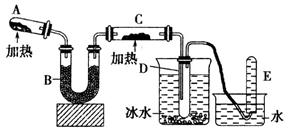
回答下列问题:
(1)A中生成氨气反应的化学方程式是_________________________________________;
(2)B中加入的干燥剂是_________(填序号)①浓硫酸②无水氯化钙 ③碱石灰;
(3)能证明氨与氧化铜反应的现象①C中______________、②D中有无色液体生成;
设计实验检验D中无色液的成分:取少量液体于试管中,加入少量________粉末,现象为_________。
(4)写出氨气与氧化铜反应的化学方程式___________________________;若收集到2.24L(STP)氮气,计算转移电子数为__________。
 烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。 管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.
管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.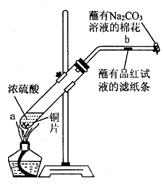
 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
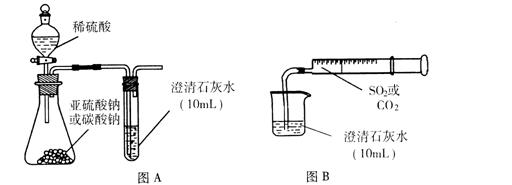
 CO2无毒和无刺激性气味。
CO2无毒和无刺激性气味。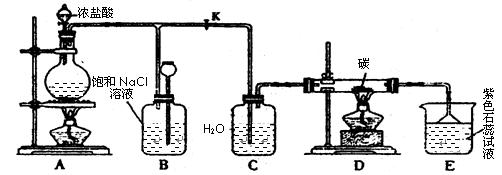
 粤公网安备 44130202000953号
粤公网安备 44130202000953号