将红热的黑色固体单质甲投入显黄色的溶液乙中剧烈反应产生混合气体A,A在常温下不与空气作用。现有如下变化关系:
气体A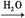
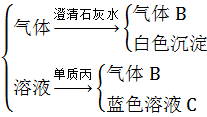
试推导:
(1)甲为 ,乙为 ,丙为 。
(2)混合气体A的主要成分是 。
(3)气体B为 ,蓝色溶液C溶质为 。
(4)甲与乙反应的化学方程式是 。
将红热的黑色固体单质甲投入显黄色的溶液乙中剧烈反应产生混合气体A,A在常温下不与空气作用。现有如下变化关系:
气体A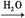
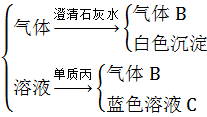
试推导:
(1)甲为 ,乙为 ,丙为 。
(2)混合气体A的主要成分是 。
(3)气体B为 ,蓝色溶液C溶质为 。
(4)甲与乙反应的化学方程式是 。