高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 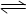 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 |
制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
 2C+D,正反应为放热反应。此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。
2C+D,正反应为放热反应。此时,A、B、C的物质的量均为a mol,而D的物质的量为d mol。 pC(g)+qD(g),符合图2-31。
pC(g)+qD(g),符合图2-31。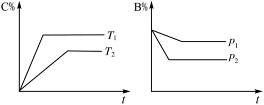
 5Ca2++3
5Ca2++3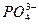 +OH-
+OH- B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表: pC达到平衡,根据以下要求填空:
pC达到平衡,根据以下要求填空: 粤公网安备 44130202000953号
粤公网安备 44130202000953号