在容积不变的密闭容器中,分别充入1.0 mol N2和3.0 mol H2,在不同温度下,任其发生反应:N2(g)+3H2(g) 2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。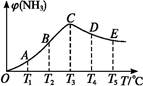
请回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是 。
(2)此可逆反应的正反应是 (填“放热”或“吸热”)反应。
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和化学平衡的角度说明理由: 。
在容积不变的密闭容器中,分别充入1.0 mol N2和3.0 mol H2,在不同温度下,任其发生反应:N2(g)+3H2(g) 2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
请回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是 。
(2)此可逆反应的正反应是 (填“放热”或“吸热”)反应。
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和化学平衡的角度说明理由: 。