“洁净煤技术”研究在世界上相当普遍,科研人员通过向煤气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达12 500~16 000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。已知:
C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1①
CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g) 2H2O(g) ΔH2=-483.6 kJ·mol-1②
2H2O(g) ΔH2=-483.6 kJ·mol-1②
C(s)+H2O(g) CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。

 数之和还多1。
数之和还多1。 。
。
 灰锡两种单质,常见的白锡银白色有金属光泽,密度7.31g/cm3,软而富有展性,导电导热能力强,在13.2℃---161℃间稳定。白锡剧冷转变为粉末状的灰锡;灰锡暗灰色固体或粉末,密度5.75g/cm3,无延展性,导电导热能力差,13.2℃以下稳定,较少应用。结构研究表明,白锡晶体中锡原子为六方最密堆积,灰锡的结构类似于金刚石。根据以上信息回答下列问题:
灰锡两种单质,常见的白锡银白色有金属光泽,密度7.31g/cm3,软而富有展性,导电导热能力强,在13.2℃---161℃间稳定。白锡剧冷转变为粉末状的灰锡;灰锡暗灰色固体或粉末,密度5.75g/cm3,无延展性,导电导热能力差,13.2℃以下稳定,较少应用。结构研究表明,白锡晶体中锡原子为六方最密堆积,灰锡的结构类似于金刚石。根据以上信息回答下列问题: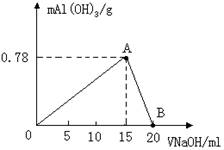
 粤公网安备 44130202000953号
粤公网安备 44130202000953号