“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、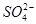 等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下: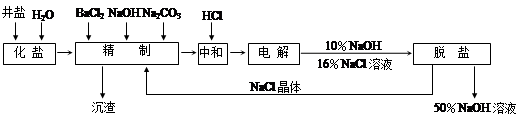
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为 ;
(2)电解过程的总反应的化学方程式_________________________________________。
(3)电解槽阳极产物可用于_____________________________(至少写出两种用途)。
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为: 。
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| NaOH /g |
109 |
118 |
129 |
146 |
177 |
300 |
313 |
318 |
337 |
| NaCl/ g |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
根据上述数据,脱盐工序中利用通过 、 (填操作名称)除去NaCl。
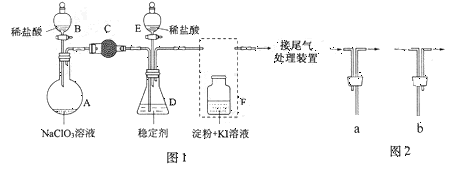

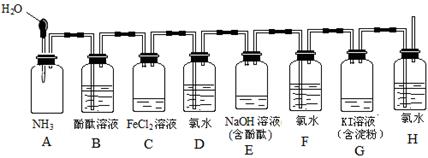


 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究. 粤公网安备 44130202000953号
粤公网安备 44130202000953号