已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。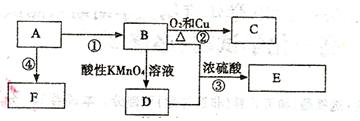
(1)A的结构简式为 。
(2)D分子中的官能团是 ,
(3)写出下列反应的化学方程式
② ④
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
(1)A的结构简式为 。
(2)D分子中的官能团是 ,
(3)写出下列反应的化学方程式
② ④