苹果酸结构如下,常用做汽水、糖果的添加剂。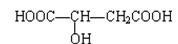
试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na 。
(2)与Na2CO3 __________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(浓H2SO4,△)_________ __ 。
苹果酸结构如下,常用做汽水、糖果的添加剂。
试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na 。
(2)与Na2CO3 __________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(浓H2SO4,△)_________ __ 。