(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| |
① |
H2(g)+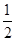 O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; |
||||||||
| |
② |
2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; |
||||||||
| |
③ |
C(s)+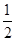 O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; |
||||||||
| |
④ |
C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; |
||||||||
| |
⑤ |
CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL |
||||||||
| 化学键 |
O=O |
C-C |
H-H |
O-O |
C-O |
O-H |
C-H |
|
||
| 键能kJ/mol |
497 |
348 |
436 |
142 |
351 |
463 |
414 |
|
||
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g)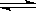 H2(g)+ CO(g)△H =" ___________" kJ/moL;
H2(g)+ CO(g)△H =" ___________" kJ/moL;
(3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2J/(g·℃) ]。
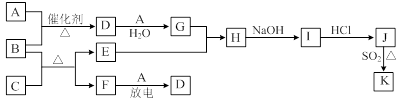
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。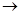 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号