(共10分)现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。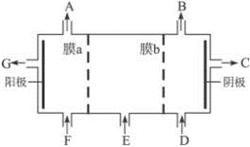
(1)写出氯碱工业中电解饱和食盐水的离子方程式 ;
(2)请利用交换膜技术,根据上图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质的化学式:
A_________;C_________; E_________;膜b为 离子交换膜(填“阳”或“阴”)。
(共10分)现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
(1)写出氯碱工业中电解饱和食盐水的离子方程式 ;
(2)请利用交换膜技术,根据上图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质的化学式:
A_________;C_________; E_________;膜b为 离子交换膜(填“阳”或“阴”)。