(10分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验: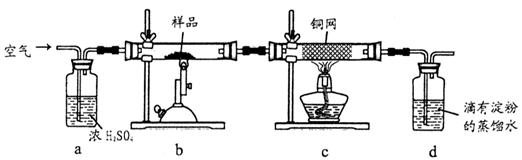
现称取研细的黄铜矿样品1.2g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,假设SO2被d完全吸收,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如图所示。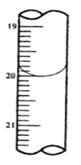
请回答下列问题:
(1)称量样品所用的仪器为________________,将样品研细后再反应,其目的是______________________________________________________。
(2)装置a的作用是________________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)c装置的作用是_______________,上述反应结束后,仍需通一段时间的空气,其目的是________。
(4)滴定时,标准碘溶液所耗体积为______mL。判断滴定已达终点的现象是_________________。
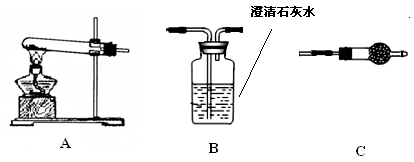
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的是________。(填编号) 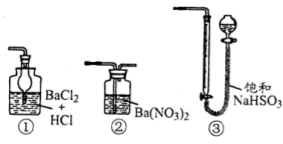
(6)该黄铜矿的纯度为:______________________。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号