X、Y、Z、W、Q、R均为前4周期元素,且原子序数依次增大。其相关信息如表所示:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y原子的2p轨道中有3个未成对电子 |
| Z元素的族序数是其周期数的3倍 |
| W原子的第一至第四电离能分别为: I1=578 kJ·mol-1 I2=1 817 kJ·mol-1 I3=2 745 kJ·mol-1 I4=11 575 kJ·mol-1 |
| Q为前4周期中电负性最小的元素 |
| 元素R位于周期表的第11列 |
请回答下列问题:
(1)Y3-的原子结构示意图为___________________,Y的氢化物的空间构型为______________。
快速制备Y的氢化物可用Y的氢化物的浓溶液与NaOH固体的原因_________________。
(2)已知YZ2+与XZ2互为等电子体,写出YZ2+的电子式____________________。
(3)R的基态原子价电子排布式为______________________,R的氯化物的水溶液与Q单质发生反应的离子方程式为____________________________________________________。
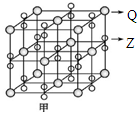
(4)化合物甲由Z、Q两种元素组成,其晶胞如图,甲的化学式为
________________。
(5)已知由X形成的自然界硬度最大的单质完全燃烧的燃烧热
为395 kJ/mol。且1 mol Z=Z键完全断裂时吸收热量497 kJ,1 mol
X=Z键形成时放出热量745 kJ,则单质X中1 mol X—X键断裂时吸收热量为___________________。
 代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未形成共价键的最外层电子,短线代表价键,如:F2
代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未形成共价键的最外层电子,短线代表价键,如:F2 。
。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号