在下图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体。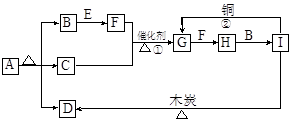
完成下列问题:
(1)写出A的化学式 。
(2)组成F的元素在周期表中位于 周期 族。
(3)B的电子式是 。
(4)反应①的化学方程式: 。
(5)反应②的离子方程式: 。
在下图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体。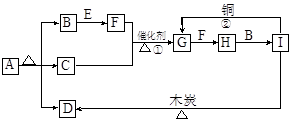
完成下列问题:
(1)写出A的化学式 。
(2)组成F的元素在周期表中位于 周期 族。
(3)B的电子式是 。
(4)反应①的化学方程式: 。
(5)反应②的离子方程式: 。