【化学一化学与技术】
氮的化合物及相关工业的生产路线如下图所示: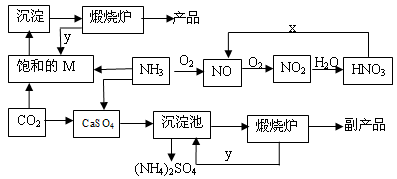
(1)M的化学式为____________;循环利用的物质y为__________________。
(2)产品的俗称是______________;副产品的俗称为______________________。
(3)若x为亮红色的单质,请写出硝酸与x反应生成NO 的离子方程式: _______________
(4)向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。
【化学一化学与技术】
氮的化合物及相关工业的生产路线如下图所示:
(1)M的化学式为____________;循环利用的物质y为__________________。
(2)产品的俗称是______________;副产品的俗称为______________________。
(3)若x为亮红色的单质,请写出硝酸与x反应生成NO 的离子方程式: _______________
(4)向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。