天然维生素P(结构如下图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是 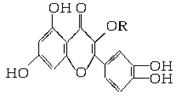
| A.可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 |
| B.可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 |
| C.一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol |
| D.维生素P能发生水解反应 |
天然维生素P(结构如下图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是 
| A.可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 |
| B.可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 |
| C.一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol |
| D.维生素P能发生水解反应 |