将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是( )
| A.35.5a=(W2-W1)V2 | B.n(Na)+3n(Al)=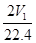 mol mol |
C.n(Al)> mol mol |
D.aV2=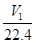 |
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是( )
| A.35.5a=(W2-W1)V2 | B.n(Na)+3n(Al)=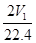 mol mol |
C.n(Al)> mol mol |
D.aV2=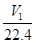 |