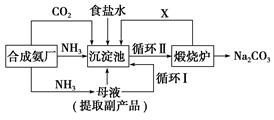
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E 、G ;F在元素周期表中的位置是 .
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是 。
(3) E在D2中燃烧生成化合物X中阴阳离子个数比为 ;X中的阴离子电子式为 .
(4)能够说明可逆反应2CD2(g)  C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;
①单位时间消耗2mol CD2的同时,生成1 mol C2D4②恒温恒压下,混合气体的密度不变③CD2和C2D4的浓度之比为2∶1 ④混合气体的颜色不变⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4
(5)向含E的最高价氧化物的水化物0.5 mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为 。
 R—Br+H2O②
R—Br+H2O②
 粤公网安备 44130202000953号
粤公网安备 44130202000953号