现有五种有机物,请回答下列问题:
A.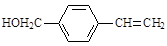 |
B. |
C.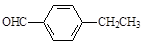 |
D.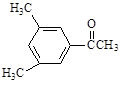 E. E.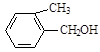 F. F.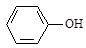 |
(1)A物质中含有的官能团名称为 、 。
(2)B的分子式为 。
(3)D的一氯代物最多有 种。
(4)上述化合物中互为同分异构体的是 ;互为同系物的是 。(填字母)
现有五种有机物,请回答下列问题:
A. |
B. |
C. |
D.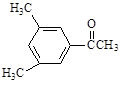 E. E.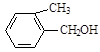 F. F.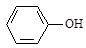 |
(1)A物质中含有的官能团名称为 、 。
(2)B的分子式为 。
(3)D的一氯代物最多有 种。
(4)上述化合物中互为同分异构体的是 ;互为同系物的是 。(填字母)