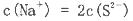下列说法正确的是:
A相同温度时,1mol/L氨水与05mol/L氨水中,c(OH-)之比是2:1
B.1mol/L氯化铵 溶液中c(NH4+)=c(Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中
D.硫化钠溶液中,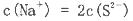
下列说法正确的是:
A相同温度时,1mol/L氨水与05mol/L氨水中,c(OH-)之比是2:1
B.1mol/L氯化铵 溶液中c(NH4+)=c(Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中
D.硫化钠溶液中,