(10分)锌与不同浓度的硫酸反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为101 kPa,温度为0 ℃)。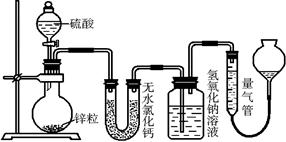
(1)若在烧瓶放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,在洗气瓶中加入1 mol/L NaOH溶液的体积V≥______mL,量气管的适宜规格是__________ (选填“200 mL”、“400 mL”或“500 mL”)
(2)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重1.28 g,则发生反应的化学方程式为:___________________________________________________________________
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到V mL气体,则有:a/65 mol=b/64 mol+V/22400 mol,依据的原理是__________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,n(H2)/n(SO2)=____ (用含字母的代数式表示)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号