铬铁矿是最难分解的矿石之一,加工前需将矿样充分粉碎。其主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
请回答:
(1)煅烧前应将铬铁矿充分粉碎,其目的是 ____。灼烧是中学化学中常用的操作方法。如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要的有 。
| A.陶瓷坩埚 | B.铁坩埚 | C.三脚架 | D.泥三角 |
(2)煅烧过程中FeO·Cr2O3发生反应的化学方程式是 。
(3)制备过程中杂质SiO2、Al2O3最终分别以(写化学式)____、____的形式被除去。
(4)向黄色的滤液2中加稀硫酸,观察到溶液逐渐变为橙色。请结合化学平衡原理和必要的文字,对此过程给予合理解释 。
(5)向Na2Cr2O7溶液加入KC1固体,获得K2Cr2O7晶体能庙橐作并衣次是:加热浓缩、____、 过滤、洗涤、干燥。
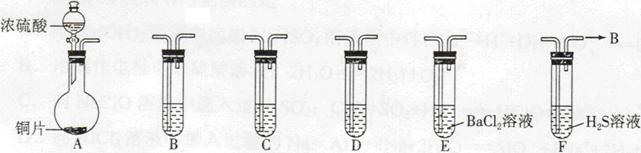


 ,发生反应的离子方程式为_____________。
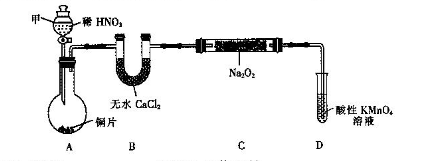
,发生反应的离子方程式为_____________。

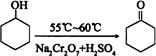

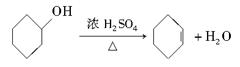
 粤公网安备 44130202000953号
粤公网安备 44130202000953号