高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。已知晶体中N—N键的键能为160 KJ/mol,而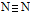 的键能为942 KJ/mol。则下列说法不正确的是
的键能为942 KJ/mol。则下列说法不正确的是
| A.键能越大说明化学键越牢固,所构成的物质越稳定 |
| B.高聚氮晶体属于原子晶体 |
| C.该晶体中氮原子数与氮氮键数比为1:3 |
| D.高聚氮可以用作炸药 |
高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构。已知晶体中N—N键的键能为160 KJ/mol,而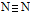 的键能为942 KJ/mol。则下列说法不正确的是
的键能为942 KJ/mol。则下列说法不正确的是
| A.键能越大说明化学键越牢固,所构成的物质越稳定 |
| B.高聚氮晶体属于原子晶体 |
| C.该晶体中氮原子数与氮氮键数比为1:3 |
| D.高聚氮可以用作炸药 |