【化学——选修物质结构与性质】X、Y、Z、M、N、Q 、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
(1)X元素在周期表中的位置是 ,它的外围电子的电子排布图为 。P元素属于 区元素,
(2)XZ2分子的空间构型是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ____________________。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。
求该晶胞密度的计算式为 g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
三聚氰胺分子中氮原子轨道杂化类型是 ,
1 mol三聚氰胺分子中 σ键的数目为 。



 CO2↑+ 2 H2O + 2SO2↑
CO2↑+ 2 H2O + 2SO2↑
 (1)写出A在加热条件下与H2反应的化学方程式
(1)写出A在加热条件下与H2反应的化学方程式


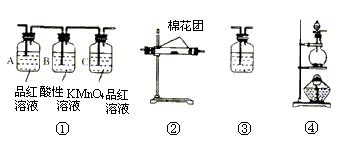

 S+SO2+OH-完全转化为S2O32-的离子方程式____________________
S+SO2+OH-完全转化为S2O32-的离子方程式____________________ 粤公网安备 44130202000953号
粤公网安备 44130202000953号