瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气探究其性质,据此回答下列问题: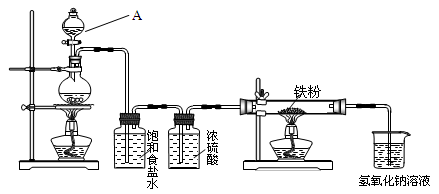
(1)A仪器的名称是 。
(2)上述制备氯气的化学反应方程式为_________________________________________,反应中浓盐酸被还原和未被还原的物质的量之比为_________。
(3)浓硫酸的作用是 ,烧杯中发生反应的离子方程式为
,作用是 。
(4)为探究铁与氯气反应的产物,某小组同学提出如下设想:
①产物只有FeCl3;②产物只有FeCl2;③ 。
甲同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果未出现血红色,再滴加氯水,出现血红色,得出结论为②是正确的;
乙同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果出现血红色,则产物中必含FeCl3。
请问上述观点错误的是 ,原因是 。
(用化学方程式或离子方程式和文字说明)



 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: _____TiCl4+_____FeCl3+_____CO
_____TiCl4+_____FeCl3+_____CO ____TiO3+____Cl2
____TiO3+____Cl2 粤公网安备 44130202000953号
粤公网安备 44130202000953号