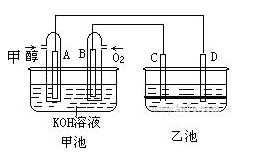
【化学——选修3:物质结构与性质】已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素。其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态。请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)元素B、C的第一电离能的大小关系是 (用元素符号填写),其原因为 。
(2)A的的某种氢化物A2H2分子的空间构型是 ,其中心A原子采取的杂化形式为 ,分子中含有 个 键, 个
键, 个 键。
键。
(3)写出E原子的核外电子排布式是 ,用电子式表示化合物DC的形成过程 。
(4)由E元素形成的金属的晶胞结构如图,已知该晶胞边长为a厘米,该晶体的密度为 。(用NA表示阿伏伽德罗常数的值)
(5)配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于 (填晶体类型)。

 CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1 HCO3-+H+的电离平衡常数Ka1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1=。(已知:10-5.60=2.5×10-6) 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。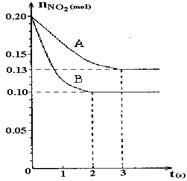

 粤公网安备 44130202000953号
粤公网安备 44130202000953号