.I.把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g); ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“>”“=”或“<”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3)已知:①C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
Ⅱ.(1) 在25℃、101 kPa下,1 g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.7 kJ,则该反应的热化学方程式应为 。
(2).由氢气和氧气反应生成1 mol液态水时放热285.8 kJ,写出该反应的热化学方程式 ______。若1g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g) + O2(g)=2H2O(g)的△H= 。
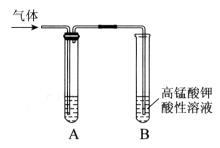


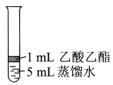


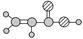

 。
。 )的合成路线示意图。
)的合成路线示意图。

 ,其工业合成路线如下:
,其工业合成路线如下:




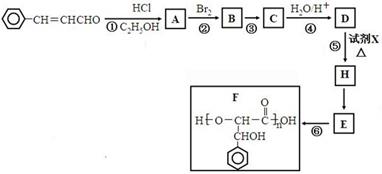

 ,现以甲苯和乙醛为原料制备3-苯基丙烯醛
,现以甲苯和乙醛为原料制备3-苯基丙烯醛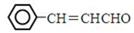 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号