(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第
(2)与浓盐酸共热生成黄绿色气体,反应的化学方程式为
(3)可由与次氯酸钠溶液反应制得,反应的离子方程式为
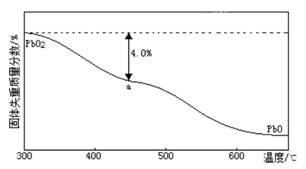
(4)在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的点为样品失重的4.0(即样品起始质量-点固体质量/样品起始质量×100)的残留固体。若点固体组成表示为或 ·,列式计算值和值 。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第
(2)与浓盐酸共热生成黄绿色气体,反应的化学方程式为
(3)可由与次氯酸钠溶液反应制得,反应的离子方程式为
(4)在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的点为样品失重的4.0(即样品起始质量-点固体质量/样品起始质量×100)的残留固体。若点固体组成表示为或 ·,列式计算值和值 。
