.为测定某地石灰石中碳酸钙的质量分数,兴趣小组同学取一定质量的石灰石于烧杯中,向烧杯中逐渐加入较浓的盐酸,反应过程测得剩余固体质量与加入盐酸的质量关系如图所示(石灰石中的杂质不与盐酸反应,也不溶与水)。请回答下列问题: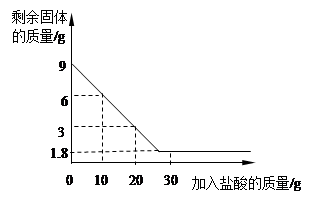
(1)石灰石中所含杂质的质量是 g。
(2)通过计算求所用盐酸的溶质质量分数。
(3)兴趣小组同学用测定产生的气体质量来求出石灰石中碳酸钙的质量分数,假如测量准确,通过计算得到的碳酸钙的质量分数比实际数值偏大,其原因可能是: 。
.为测定某地石灰石中碳酸钙的质量分数,兴趣小组同学取一定质量的石灰石于烧杯中,向烧杯中逐渐加入较浓的盐酸,反应过程测得剩余固体质量与加入盐酸的质量关系如图所示(石灰石中的杂质不与盐酸反应,也不溶与水)。请回答下列问题: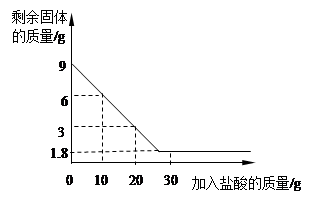
(1)石灰石中所含杂质的质量是 g。
(2)通过计算求所用盐酸的溶质质量分数。
(3)兴趣小组同学用测定产生的气体质量来求出石灰石中碳酸钙的质量分数,假如测量准确,通过计算得到的碳酸钙的质量分数比实际数值偏大,其原因可能是: 。