工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|


该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。

相关知识点

 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。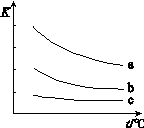


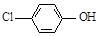 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号