尿素[]是首个由无机物人工合成的有机物.
(1)工业上尿素由和在一定条件下合成,其反应方程式为
(2)当氨碳比=4时,的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆()
②NH3的平衡转化率为
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.
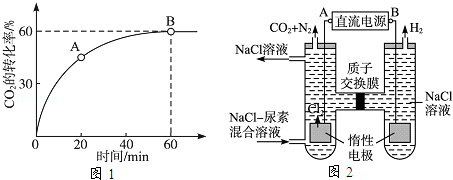
①电源的负极为
②阳极室中发生的反应依次为
③电解结束后,阴极室溶液的pH与电解前相比将
尿素[]是首个由无机物人工合成的有机物.
(1)工业上尿素由和在一定条件下合成,其反应方程式为
(2)当氨碳比=4时,的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆()
②NH3的平衡转化率为
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.

①电源的负极为
②阳极室中发生的反应依次为
③电解结束后,阴极室溶液的pH与电解前相比将