(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示: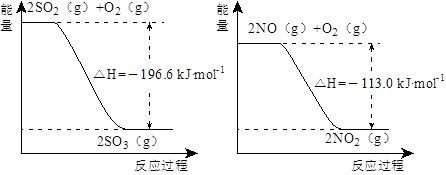
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)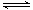 N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| 总压强p 100 kPa |
5 |
5.6 |
6.4 |
6.8 |
7 |
7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示: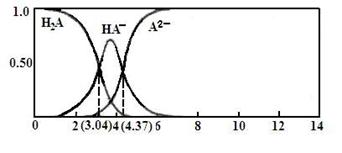
已知:103.04=1.1×103,104.37=2.3×104 25℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值 (填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值 。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2= 。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: 。
 Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是,写出铝粉与所用试剂反应的离子方程式。
Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是,写出铝粉与所用试剂反应的离子方程式。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号