在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
| A.在该条件下,反应前后的压强之比为6:5.3 |
| B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
 都具有氧化性,其氧化性
都具有氧化性,其氧化性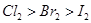 ,
, 能把溴从溴化物中置换出来,其余依次类推。向
能把溴从溴化物中置换出来,其余依次类推。向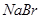 、
、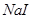 的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是
的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是 粤公网安备 44130202000953号
粤公网安备 44130202000953号