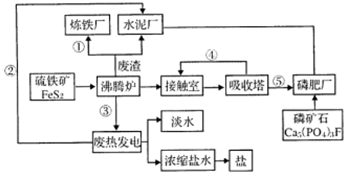
(14分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。

请回答下列问题。
(1)装置Ⅱ中NO在酸性条件下生成NO2—的离子方程式。
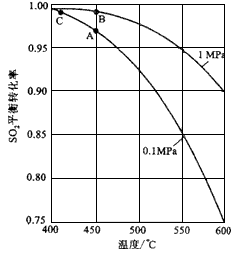
(2)含硫各微粒(H2SO3、HSO3—和SO32—)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。

①下列说法正确的是(填标号)。
| A.pH=7时,溶液中c( Na+)<c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH=2和 pH=9时的溶液中所含粒子种类不同 |
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是。
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。图中A为电源的(填“正”或“负”)极。右侧反应室中发生的主要电极反应式为。

(4)已知进入装置Ⅳ的溶液中NO2—的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO2—完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为L。
 CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.



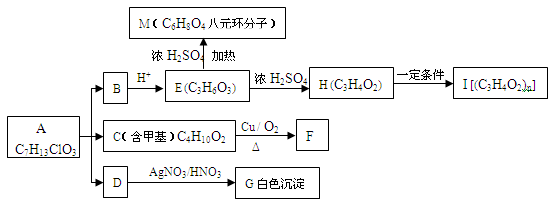
 B、C、D;
B、C、D; I;
I;
 粤公网安备 44130202000953号
粤公网安备 44130202000953号