高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 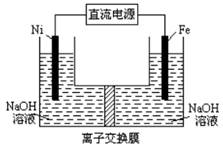
A铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C若隔膜为阴离子交换膜,则OH-自右向左移动
D电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 
A铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C若隔膜为阴离子交换膜,则OH-自右向左移动
D电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)