工业上常用铁质容器盛装冷浓硫酸,为研究铁质材料与热浓硫酸的反应,某学校学习小组进行以下探究实验:
[一](1)将已除去表面氧化物的铁钉(碳素钢)放入冷的热的浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 ;
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用
(选填序号)
a.KSCN溶液和氯水 .b铁.粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应SO2+Br2+2H2O═2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g由于此推知气体Y中SO2的体积分数为 ;
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体,为此设计了下列探究实验装置(图中夹持仪器省略)
(3)装置B中试剂的作用是 ;
(4)认为气体Y中还含有Q的理由是 ;(用化学方程式表示)
(5)为确认Q的存在,需在装置中添加M于 (选填序号)
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验的现象应是 ;
(7)若要测定限定体积气体Y中H2含量(标准状况下约有28ml H2),除用测量H2体积方法外,否选用质量称量方法?做出判断并说明理由 。

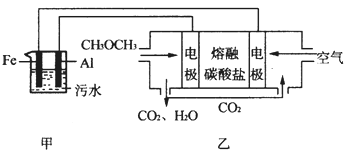

 4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1 2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
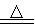 AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号