图①-⑪分别代表有关反应中的一种物质,请填下以下空白。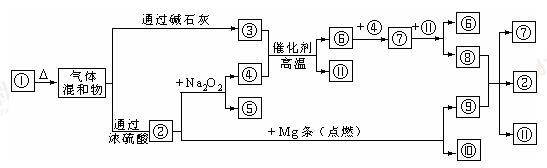
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为 ;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是 。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式 。
图①-⑪分别代表有关反应中的一种物质,请填下以下空白。
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为 ;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是 。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式 。