一定温度下,在溶剂为1L的密闭容器内放入2molN2O4和8molNO2,发生如下反应2 NO2(红棕色) N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为: 。
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol· L-1· s-1。
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: 。
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率。
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)。
相关知识点
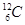 原子质量的
原子质量的 比值
比值
 的含义
的含义 粤公网安备 44130202000953号
粤公网安备 44130202000953号