第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含���6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A.共价键 B.非极性键 C.配位键D.σ键 E.π键
写出一种与 CN-互为等电子体的单质的分子式 。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于 区。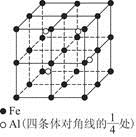
(4)一种Al—Fe合金的立体晶胞如图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度为ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号