大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 (填“酸性”或“碱性”)溶液,其原因用离子方程式解释是: 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小” )
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为: Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连


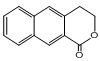 是一种重要的药物合成中间体,请结合题目所给信息,写出以
是一种重要的药物合成中间体,请结合题目所给信息,写出以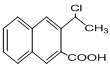 为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: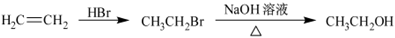
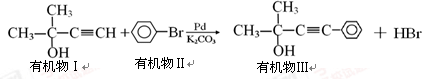
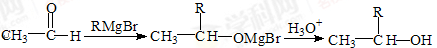
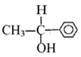 ,则需要两种有机物的结构简式分别是 。
,则需要两种有机物的结构简式分别是 。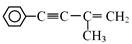 的反应方程式 。
的反应方程式 。 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。


 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号