有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合图所示的质量关系.(不计损耗)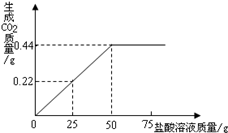
(1)样品完全反应后,共放出二氧化碳气体的物质的量为 mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合图所示的质量关系.(不计损耗)
(1)样品完全反应后,共放出二氧化碳气体的物质的量为 mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)