某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为 ,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个s键, 个p键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。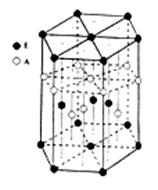

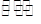 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H0(填“大于”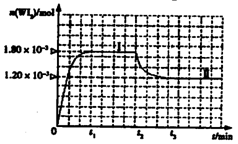
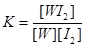
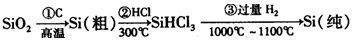
 CO2(g)+C(s),T=980 K时,ΔH-TΔS=0,当体系温度低于980 K时,估计ΔH-TΔS应__________0(填“大于”“小于”或“等于”),该反应________________进行;当体系温度高于980 K时,ΔH-TΔS应________________0。在冶金工业中,以碳作还原剂,温度高于980 K时的氧化产物以________________为主,低于980 K时以________________为主。
CO2(g)+C(s),T=980 K时,ΔH-TΔS=0,当体系温度低于980 K时,估计ΔH-TΔS应__________0(填“大于”“小于”或“等于”),该反应________________进行;当体系温度高于980 K时,ΔH-TΔS应________________0。在冶金工业中,以碳作还原剂,温度高于980 K时的氧化产物以________________为主,低于980 K时以________________为主。 P(g)+Q(g) ΔH>0,
P(g)+Q(g) ΔH>0, 2SO3 ΔH<0。
2SO3 ΔH<0。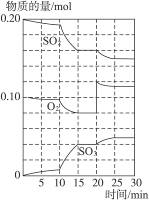
 粤公网安备 44130202000953号
粤公网安备 44130202000953号