由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示: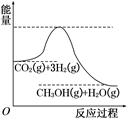
(1)上述反应平衡常数K的表达式为 ,温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)= 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是 (填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
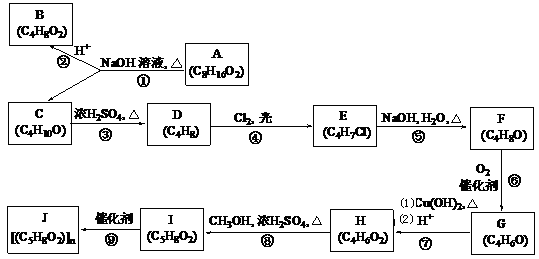
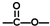 ”结构的链状化合物共有________种;写出(i)能发生水解反应
”结构的链状化合物共有________种;写出(i)能发生水解反应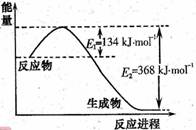
 2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。 TiCl4+ FeCl3+ CO
TiCl4+ FeCl3+ CO LixC,下列有关说法正确的是
LixC,下列有关说法正确的是 粤公网安备 44130202000953号
粤公网安备 44130202000953号