红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题: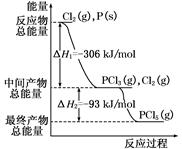
(1)P和Cl2反应生成PCl3的热化学方程式是 ;
(2)P和Cl2分两步反应生成1 mol PCl5的ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”、或“等于”)。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是 ;
(2)P和Cl2分两步反应生成1 mol PCl5的ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”、或“等于”)。