在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g) 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。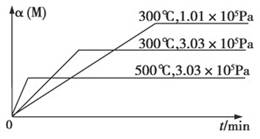
下列对W容器中进行的反应推断合理的是
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则v正(B):v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g) 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
下列对W容器中进行的反应推断合理的是
A.反应①一定是自发反应,反应②一定是非自发反应
B.若容器内温度保持不变,则v正(B):v逆(C)=2:3
C.若恒压条件下,充入N,则C的物质的量减小
D.升高温度,两个反应的平衡常数都减小