已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。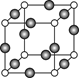
 点_____
点_____ Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: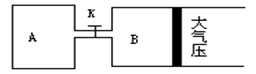
 粤公网安备 44130202000953号
粤公网安备 44130202000953号